Introduction
Le salage des routes en période de grand froid permet de favoriser la fonte de la neige ou de la glace sur la chaussée, ce qui tend à réduire les risques de dérapages. Différents sels peuvent être utilisés. Le plus souvent, ce sera du chlorure de sodium (comme sel de table) ou du chlorure de calcium. Comment ça marche, et y'a-t-il des produits chimiques plus intéressants à utiliser que d'autres?

Cette page est en lien avec un article publié dans le journal Le Progrès: Comment le sel fait-il fondre la glace?
Mécanisme principal de fonte: la présence d'impuretés dans l'eau perturbe sa cristallisation
Observation
Lorsque de la glace est faite d'eau pure, elle fond à 0 °C. Mais quand du sel est saupoudré sur la glace, celle-ci peut se liquéfier, même si la température extérieure est en-dessous de 0 °C. On dit que le sel abaisse la température de fusion (ou le point de congélation) de l'eau. Lorsque le sel est du chlorure de sodium (sel de table), la route peut typiquement être déneigée pour des températures extérieures descendant jusqu'à environ -9 °C.
Explication
Pour comprendre comment la glace fond à une température plus basse que 0 °C en présence de sel, il est plus simple de considérer le problème inverse: En dessous de quelle température une solution d'eau salée va-t-elle se solidifier en glace?
Solidification de l'eau pure
Considère tout d'abord de l'eau pure. La transition entre l'état liquide et l'état solide se produit à 0 °C, car à cette température, on observe un équilibre où, au niveau microscopique, il y a, à chaque instant, autant de molécules d'eau passant de la phase liquide à la phase solide que de molécules passant de la phase solide à la phase liquide:
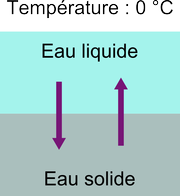
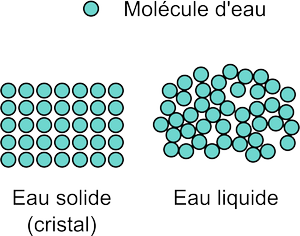
La différence entre les états liquide et solide se voit au niveau microscopique. Dans un solide tel que la glace, les molécules sont arrangées de manière très ordonnée et périodique selon une structure cristalline: les molécules peuvent difficilement bouger les unes par rapport aux autres. Dans un liquide, la température est suffisante pour que l'agitation thermique permette aux molécules de se déplacer les unes contre les autres, et l'état est plutôt désordonné.
Solidification de l'eau salée
Les sels purs sont solides à température ambiante. Lorsqu'ils sont mélangés à l'eau, ils se dissolvent, ce qui donne un liquide unique, mélange de molécules d'eau et d'ions (atomes avec une charge électrique). Par exemple, le sel de table est composé d'atomes de chlore $\mathrm{Cl}$ et d'atomes de sodium $\mathrm{Na}$ qui se dissocient en ions chlorure $\mathrm{Cl}^-$et sodium $\mathrm{Na}^+$ en présence d'eau:
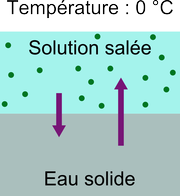
$$\mathrm{NaCl}_{\text{(solide)}} \rightarrow \mathrm{Na}^+_{\text{(aqueux)}} + \mathrm{Cl}^-_{\text{(aqueux)}}$$Microscopiquement, une solution d'eau salée ressemble donc à ceci:

Comment une telle solution peut-elle cristalliser? Le cristal sera principalement fait d'eau pure car les ions peuvent difficilement s'incruster dans le réseau cristallin périodique de l'eau. Or, en raison de la présence des ions dans la phase liquide, moins de molécules d'eau sont disponibles près de l'interface. À 0 °C, le nombre de molécules passant de l'état liquide à solide sera donc plus faible que dans le schéma de l'eau pure précédent. Ceci est représenté ainsi:
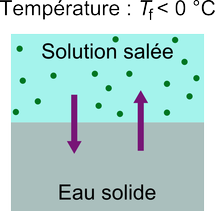
Comme il y a désormais, à 0 °C, moins de molécules passant de l'état liquide à solide que de solide à liquide, le système va évoluer et se liquéfier. Pour rétablir l'équilibre, il faut trouver un moyen de défavoriser la liquéfaction: il faut diminuer la température.
En raison de la baisse de concentration de l'eau dans la phase liquide à cause des ions du sel, la température de fusion est donc abaissée à une valeur en dessous de 0 °C.
De quels paramètres dépend la température de fusion d'un mélange d'eau salée?
D'après l'explication précédente, le paramètre important qui contrôle le point de fusion du mélange est le nombre de particules qui jouent le rôle d'impuretés par rapport au nombre de molécules d'eau (ou le nombre total de particules). On en tire deux conclusions:
-
Ce phénomène ne dépend pas, en première approximation, des propriétés chimiques des impuretés.
-
Le point de fusion dépend de la concentration en impuretés dissoutes dans le système. Plus il y a d'impuretés, plus le point de fusion est abaissé.
Les composés chimiques qui permettent d'abaisser le plus la température de fusion (à masse de poudre égale) sont donc ceux qui
-
se dissocient en un grand nombre de particules dans l'eau,
-
peuvent être dissouts en grande quantité dans l'eau.
Le premier point illustre l'intérêt des sels dans le dégivrage. Lorsqu'ils sont dissouts dans l'eau, ils se dissocient en de nombreuses petites particules. A l'inverse, des poudres solubles tels que le sucre ne se dissocient pas en ions, et le nombre de particules dissoutes est alors faible, même si la masse de sucre dissoute est élevée.
Le deuxième point doit être pris en compte car il est impossible de dissoudre une quantité infinie de sel dans un volume d'eau donnée. Si tu prends un verre d'eau tu pourras dissoudre quelques cuillères de sel dedans en mélangeant bien. Mais à un moment, le sel que tu rajoutes ne pourras pas se dissoudre et restera solide. La partie liquide dans le verre est alors une solution dite saturée en sel.
Autres mécanismes à prendre en compte
La chute de la température de fusion expliquée précédemment est le mécanisme principal expliquant la fonte. Cependant, d'autres phénomènes entrent également en jeu.
Changement de température du à l'action du sel
Fondre la glace avec une solution salée peut dégager de la chaleur ou au contraire en absorber. Lorsque de la chaleur est dégagée, la température augmente, ce qui facilite la fonte. Cette propriété dépend du type de sel utilisé. Par exemple, le chlorure de sodium refroidit légèrement la route en la faisant fondre. (Avant que les congélateurs n'existent, des mélanges de sel de table et de glace étaient d'ailleurs utilisés pour fabriquer des crèmes glacées.) À l'inverse, le chlorure de calcium réchauffe la chaussée.
Affinité du sel avec les molécules d'eau
Dans un modèle simpliste, les étapes de l'élimination du verglas sur une route peuvent être résumées ainsi:
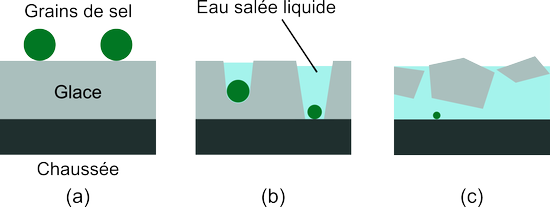
En (a), les grains de sel sont déposés sur le verglas. (b) Ceux-ci, en se dissolvant, fondent la glace et y creusent des cavités. Comme les grains de sel coulent dans l'eau, il ont tendance à creuser vers le bas. (c) La glace se fragmente et les morceaux qui ne sont pas fondus baignent dans une solution d'eau salée. L'ensemble forme une sorte de boue neigeuse qui peut s'écouler hors de la route.
Dans ce processus, la fonte a du mal à démarrer car en (a) la surface de contact entre les grains et la glace est faible: il n'y a en fait pas encore de couche liquide entre les deux! Certains sels, initialement secs, sont cependant capables d'absorber les molécules d'eau présentes dans l'air (voir la première expérience de cette page). On dit alors que ces sels sont hygroscopiques. Pour de tels sels, dont le chlorure de sodium fait partie, un film liquide va se former à la surface des grains et commencer à les dissoudre. Cette couche liquide va ensuite entrer en contact avec la glace, et le processus de fonte de la glace dans une solution d'eau salée liquide prend alors place.
En pratique, le problème de contact en (a) peut être évité: les sels sont parfois prémouillés avant de les déposer sur les routes. Le dégivrage des avions commerciaux se fait d'ailleurs avec des liquides, afin que la fonte ne prenne que quelques minutes.
Prise en compte de paramètres environnementaux
Outre la température extérieure, de nombreux paramètres peuvent être inclus dans les modèles de fonte du verglas:
-
Vent: favorise l'évaporation, et affecte la température
-
Transfert de chaleur provenant du sol par la chaussée
-
Passage de voitures sur la route: celles-ci favorisent:
-
la dissolution et la répartition du sel en mélangeant la phase liquide,
-
le décollement des plaques de verglas,
-
l'évacuation du mélange d'eau salée et de morceaux de glace sur les bas-côtés.
-
Sels utilisés
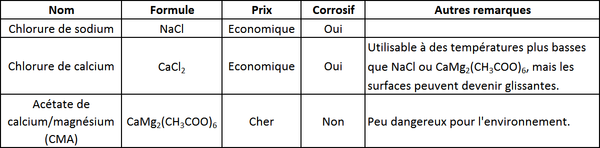
Le tableau suivant montre les avantages et inconvénients de trois fondants routiers. Les deux premiers sont employés très couramment. Depuis les dernières décades, les quantités de sel utilisées ont fortement augmenté, et les effets sur l'environnement de cette utilisation à grande échelle sont étudiés par des chercheurs. L'acétate de calcium/magnésium (CMA) semble être assez "propre", mais il coute encore cher et est donc rarement utilisé.
Sources
-
Tableau comparatif de différents sels:
-
Deux modèles de fonte de verglas:
-
Chemistry of Deicing Roads: Penetrating Ice, J. Transp. Eng. 114 (1988), pp. 221-229
-
A road surface freezing model using heat, water and salt balance and its validation by field experiments, Cold Regions Science and Technology 106-107 (2014) pp. 1-10
-
-
Comparaison de l'écotoxicité de trois sels:
Ecotoxicological Evaluation of Three Deicers (NaCl, NaFo, CMA) — Effect on Terrestrial Organisms
