Ce qu'il te faut
- Acétate de sodium en poudre (anhydre ou trihydraté)
- Un congélateur
- Un thermomètre digital (idéalement avec un fil pour pouvoir avoir la sonde dans le congélateur et l'afficheur à l'extérieur)
- Casserole et plaque de cuisson
- Un pot en verre avec couvercle (pot de confiture par exemple)
- Un récipient à fond plat (assiette, moule à gratin...)
- Une balance
- Une cuillère
Introduction
Les expériences ci-dessous utilisent une solution concentrée d'acétate de sodium. C'est un mélange qui a la propriété de pouvoir être surfondu (c'est-à-dire d'être liquide à une température où il devrait être solide) et de pouvoir cristalliser en quelques secondes en dégageant de la chaleur.

Préparation de la solution d'acétate de sodium
A l'aide de la balance, mélange dans le pot de confiture 120 g d'acétate de sodium trihydraté avec 40 g d'eau (ou 75 g d'acétate de sodium anhydre avec 90 g d'eau). En mélangeant avec la cuillère, il n'est pas possible de dissoudre tout l'acétate de sodium. On va donc chauffer au bain-marie pour obtenir une solution liquide :
-
Place le pot en verre au milieu de la casserole.
-
Remplis la casserole d'eau jusqu'à ce que le niveau de liquide dans la casserole soit au-dessus du niveau de liquide dans le pot en verre.
-
Place le couvercle sur le pot sans le fermer.
-
Chauffe à feu moyen et maintient l'eau de la casserole en ébullition.
Lentement, les cristaux d'acétate de sodium devraient se dissoudre à l'intérieur du récipient en verre. Quand tu ne vois plus de cristaux, attends 5 min et éteins le feu. Referme le pot avec le couvercle (attention, c'est chaud !) et laisse refroidir. Normalement, la solution devrait pouvoir refroidir jusqu'à température ambiante sans cristalliser. Si la solution cristallise, rajoute un peu d'eau dans le pot de confiture et recommence le chauffage au bain-marie.


Cristallisation à grande vitesse
Expérience
Dans le récipient à fond plat, verse quelques centilitres de solution liquide d'acétate de sodium. Si tout va bien, la "flaque" d'acétate de sodium devrait rester liquide. Jette un petit grain d'acétate de sodium au centre de la flaque. La solution devrait cristalliser en quelques secondes, en commençant par l'endroit où le grain de poudre a été déposé. Au passage, remarque en touchant le produit cristallisé que la réaction produit de la chaleur.

 vidéo (1,77 Mo)) et de plusieurs germes (
vidéo (1,77 Mo)) et de plusieurs germes ( vidéo (1,13 Mo)).
vidéo (1,13 Mo)).Que s'est-il passé ?
La solution de départ est liquide à température ambiante. Elle est cependant dans un état métastable, c'est-à-dire qu'elle préfèrerait être à l'état solide à cette température (comme par exemple de l'eau à moins de 0 °C). La cristallisation peut alors être amorcée par de toutes petites perturbations du système, par exemple par l'ajout d'un grain d'acétate de sodium. Une fois que la cristallisation commence, elle se poursuit jusqu'à ce que tout l'acétate de la solution cristallise et le système atteint alors son état d'équilibre. Comme la cristallisation est une réaction qui libère de la chaleur, la température augmente.
C'est réversible
Le produit obtenu après cristallisation est un mélange d'acétate de sodium et d'eau. Tu peux le récupérer dans le pot en verre et le remettre au bain marie pour le liquéfier à nouveau et le réutiliser.
Stalagmite d'acétate de sodium
Une autre manière de faire l'expérience précédente est de partir d'un grain de poudre et de verser du liquide par dessus :
-
Place un grain d'acétate de sodium au centre de l'assiette.
-
Verse lentement sous la forme d'un filet de liquide la solution d'acétate de sodium comme sur la photo en introduction. Une colonne de cristaux se forme au fur et à mesure que tu verses le liquide.

 Télécharger la vidéo (3,20 Mo).
Télécharger la vidéo (3,20 Mo)."Chauffer" en refroidissant ?
Un liquide métastable permet de conserver et de restituer de la chaleur dans des conditions un peu étranges. On peut par exemple faire augmenter la température d'un système en le refroidissant. L'expérience est très simple :
-
Place le pot de confiture rempli d'environ 20 cL de solution d'acétate de sodium dans le congélateur avec la sonde du thermomètre trempant dedans.
-
Toutes les cinq minutes, note la température. Tu peux aussi ouvrir rapidement le congélateur de temps en temps pour noter l'état du système : liquide ou cristallisé.
-
Trace le graphe de la température en fonction du temps. Tu devrais obtenir quelque chose qui ressemble à ceci :
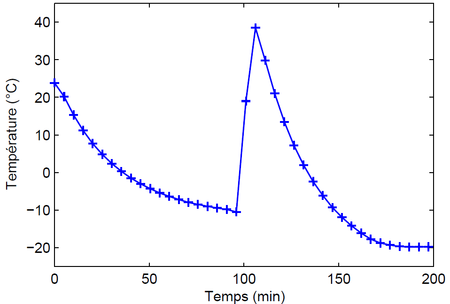
Au début, la température diminue avec le temps. C'est normal, car le congélateur refroidit le système. Mais à un moment (100 minutes sur mon graphe), alors que le congélateur est toujours en train de refroidir, la température augmente et atteint près de 40 °C ! Cela se produit lorsque la solution cristallise, car la cristallisation libère de la chaleur. Une courbe de refroidissement de cette forme avec un brusque changement de température lors d'un changement d'état est caractéristique d'un système métastable.
Application pratique : les chaufferettes
L'acétate de sodium est utilisé dans certaines chaufferettes qui se glissent dans une poche d'un manteau par temps froid. La chaufferette est préparée en la plongeant dans l'eau bouillante. Les cristaux qu'elle contient se dissolvent entièrement et emmagasinent de la chaleur. La chaufferette peut ensuite se conserver à température ambiante. Pour l'utiliser, il suffit de déclencher la cristallisation, ce qui va libérer la chaleur. La cristallisation est généralement produite par la torsion d'une petite lamelle métallique présente à l'intérieur de la chaufferette.

