Introduction
Cette page explique le principe de fonctionnement d'un polymère superabsorbant (PSA) couramment utilisé: le polyacrylate de sodium. Le polymère se présente généralement sous la forme d'une poudre blanche qui est capable d'absorber environ une centaine de fois sa masse d'eau liquide pour former un gel solide. Ce polymère est notamment utilisé dans les couches culottes, certaines neiges artificielles décoratives et dans des gels désodorisants.
Pour des expériences, regarde plutôt la page suivante.

Dissolution du sel dans l'eau
Dans les explications suivantes, les ions (particules résultant de la dissolution d'un sel) sont représentés par des sphères et les polymères (longues chaines d'atomes qui forment une molécule) par des chaines linéaires:
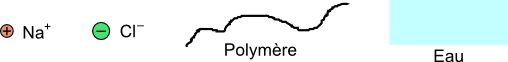
Pour comprendre comment un PSA peut absorber tant d'eau, rappelle-toi comment du sel se dissous dans l'eau. La structure du sel de cuisine (NaCl) est cristalline. Les grains sont solides et sont constitués d'un nombre égal d'ions sodium $\mathrm{Na}^+$ et d'ions chlorure $\mathrm{Cl}^-$. Rappelle-toi que les ions portent une charge, que deux ions de signes opposés s'attirent et que deux ions de même signe se repoussent:
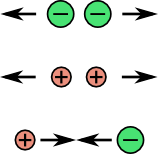
L'équation de dissolution du sel dans l'eau est la suivante:
$$\mathrm{NaCl}_\mathrm{solide} = \mathrm{Na}^+_\mathrm{soluté} + \mathrm{Cl}^-_\mathrm{soluté}$$Dans l'état cristallin, les atomes sont arrangés selon une structure serrée et régulière dans laquelle chaque charge positive est fortement liée aux charges négatives voisines par des forces électrostatiques. L'eau peut casser ces liens et permettre aux charges de se séparer, ce qui permet aux ions chlorure et sodium de nager librement dans l'eau.
Le polyacrylate de sodium
Qu'est-que le polyacrylate de sodium
C'est un polymère. Un polymère est une longue molécule qui est faite de la répétition d'un motif formé par des atomes. Ce motif est appelé monomère. La formule chimique d'un polymère est décrite par la structure du monomère et par comment les monomères sont accrochés entre-eux:
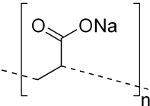
Dans cette représentation, le monomère est la partie à l'intérieur des parenthèses. Celle-ci est répétée $n$ fois en reliant le bout à droite d'un monomère au bout à gauche du monomère suivant. $n$ est typiquement très grand (beaucoup plus que 1000 pour les polymères superabsorbants) et varie d'une chaine à l'autre. Pour cette raison, le polymère est représenté sur les dessins par une simple longue chaine.
Dissolution du polyacrylate de sodium
Le polyacrylate de sodium sous forme solide (en poudre) contient des atomes de sodium accrochés à des atomes d'oxygène. Le lien peut être cassé en dissolvant le polymère dans l'eau, comme dans le cas du sel de cuisine :
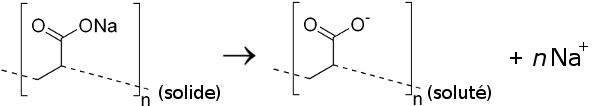
Dans l'état solide, les chaines de polymère sont repliées sur elle-mêmes. Comme chaque atome d'oxygène est relié à un atome de sodium, l'ensemble des deux a une charge nulle, et il n'y a pas de forces attractives ou répulsives entre les différents morceaux d'une chaine.
Dans l'eau, la chaine se retrouve dénudée des atomes de sodium qui sont devenus des ions $\mathrm{Na}^+$ libres. La chaine devient alors chargée négativement (au niveau des atomes d'oxygène) et les différents morceaux de chaines se repoussent: la chaine se déplie en permettant aux molécules d'eau de s'insérer autour.

Absorption d'eau et formation d'un gel
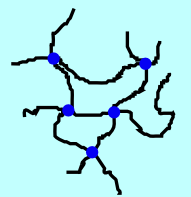
Le dépliement des chaines par répulsion électrostatique est la clé pour comprendre pourquoi le polyacrylate de sodium peut absorber beaucoup d'eau. Mais il reste un détail à clarifier. Dans le polymère dissout montré dans la section précédente, les longues chaines dépliées peuvent se déplacer assez librement dans l'eau, comme les ions sodium. L'état du système n'est donc pas un gel solide, mais une solution aqueuse (peut-être juste un peu plus visqueuse que de l'eau pure). Pour obtenir un gel, le polymère a en fait été fabriqué de manière à ce que les différentes chaines de polymère soient attachées entre-elles à divers endroits appelés ponts. Ces ponts (points bleus dans le schéma ci-dessous) sont présents dans le polymère solide, mais aussi dans le polymère dissout. La structure du polymère dissout est alors un grand réseau de chaines accrochées entre-elles et étirées (car chargées négativement). Les molécules d'eau peuvent rester piégées entre les chaines: le tout est donc un gel duquel l'eau peut difficilement s'échapper. Comme les chaines sont dépliées en présence d'eau, beaucoup de liquide peut s'insérer entre les chaines et le polymère est superabsorbant.