Introduction
Lorsque l'on frotte une paille (ou un peigne, ou encore un ballon de baudruche) sur un chiffon doux (par exemple une laine), la paille se charge d'électricité statique. Elle peut alors attirer des objets d'une charge de signe opposé et repousser des objets ayant une charge de même signe.
Un résultat plus étrange est que la paille peut attirer de l'eau par exemple lorsqu'on la rapproche d'un filet d'eau coulant d'un robinet. L'eau n'est pourtant pas chargée (elle est neutre). Comment est-ce possible?

Explication
C'est un problème d'électrostatique
Bien que l'eau soit neutre globalement, elle est constituée d'atomes, et donc d'électrons et de protons qui sont des particules chargées négativement et positivement (respectivement). C'est la façon dont les charges se répartissent dans l'eau en présence de la paille qui va expliquer la force d'attraction vers la paille.
L'électrostatique est la science qui décrit les forces qui agissent entre des particules chargées. Une charge crée autour d'elle un champ électrique qui permet de calculer l'interaction d'une particule chargée dans ce champ. Pour comprendre le problème de l'eau et la paille, il suffit de connaitre les lois d'électrostatique suivantes:
-
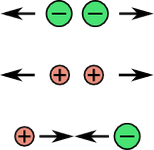
(1) Deux charges de même signe se repoussent.
-
(2) Deux charges de signes opposés s'attirent.
-
(3) Plus les charges sont proches, plus la force d'attraction/répulsion est grande.
Structure de l'eau et dipôles
Une molécule d'eau est un assemblage d'un atome d'oxygène O et de deux atomes d'hydrogène H. L'angle formé par les atomes H-O-H fait environ 105°:
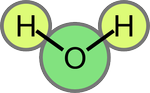
Les électrons de la molécule d'eau (qui proviennent des atomes individuels) gravitent autour des noyaux des atomes H, O et H et forment ce qui s'appelle un nuage électronique. En raison des propriétés des atomes d'hydrogène et d'oxygène, il se fait que les électrons ont tendance à être un peu plus proches du noyau de l'atome d'oxygène que de ceux d'hydrogène. Les noyaux étant chargés positivement et les électrons du nuage négativement, la répartition des charges dans une molécule d'eau ressemble à ceci:

Cette distribution inhomogène de charges peut être modélisée par un système à deux charges que l'on note $+$ et $-$. L'ensemble de ces deux charges est appelé "dipôle". Dans toute la suite, on représente les molécules d'eau par des dipôles, c'est-à-dire par des flèches sur les schémas.
Structure de l'eau liquide (sans paille)
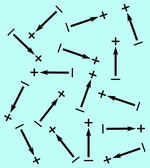
L'eau est faite de nombreuses molécules d'eau, et donc de nombreux dipôles microscopiques. A l'état liquide, les dipôles peuvent bouger les uns par rapport aux autres et également changer d'orientation. Dans le cas habituel sans champ électrique extérieur (sans paille), les dipôles sont orientés aléatoirement:
Structure et déviation de l'eau en présence d'un champ électrique extérieur (avec paille)
Une fois frottée avec un chiffon, la paille a une charge globale non nulle. Supposons qu'elle soit positive. En plaçant la paille près d'un filet d'eau, les dipôles de l'eau vont interagir avec le champ électrique créé par la paille. Si l'on regarde un seul dipôle, la présence de la paille a deux effets:
-
D'après les lois (1) et (2), la charge $+$ du dipôle est repoussée par la paille et la charge $-$ est attirée. Le dipôle s'oriente donc de manière à avoir la charge $-$ en face de la paille.
-
La charge $-$ se retrouve alors plus proche de la paille que la charge $+$. D'après la loi (3), la force d'attraction entre la charge $-$ du dipôle et la paille va être plus grande que la force de répulsion entre la charge $+$ du dipôle et la paille. En additionnant les deux forces, on trouve que le dipôle est attiré par la paille.
Les règles ci-dessus s'appliquent à tous les dipôles qui constituent l'eau. En pratique, les dipôles ne seront pas tous exactement alignés de manière à avoir la charge $-$ en face de la paille car les fluctuations thermiques dans le liquide permettent aux dipôles de changer d'orientation. Mais en moyenne, il y a tout de même plus de dipôles montrant la face $-$ à la paille que de dipôles montrant la face $+$.
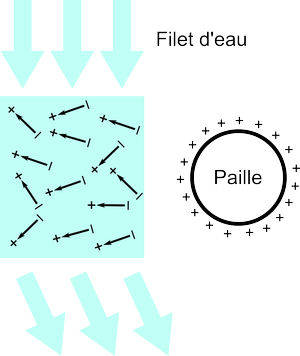
Les dipôles qui ont toujours la face $+$ du côté de la paille sont, eux, repoussés par la paille. Ceux-ci étant moins nombreux que les dipôles dont la face $-$ pointe vers la paille, la somme des forces d'interaction des dipôles avec la paille donne une force globale attractive qui dévie le filet d'eau vers la paille.
Des structures ordonnées de quelques molécules augmentent la force d'attraction
L'explication ci-dessus permet de comprendre qualitativement pourquoi l'eau est attirée par une paille chargée. Des calculs plus détaillés montrent cependant que, d'après la théorie décrite précédemment, l'eau devrait être déviée moins fortement que ce qui est observé par l'expérience. Il existe donc un mécanisme qui augmente la force d'attraction.
L'eau est un liquide très particulier dans lequel les molécules interagissent très fortement entre-elles. En particulier, un atome d'hydrogène d'une molécule peut se lier faiblement (et temporairement) à un atome d'oxygène d'une molécule voisine. Cette interaction est appelée liaison hydrogène. Une conséquence est qu'une molécule d'eau aura quelques molécules voisines qui auront tendance à se placer autour de la molécule centrale de manière à favoriser la création de liaisons hydrogènes. La structure tridimensionnelle obtenue est un tétraèdre avec une molécule au centre et quatre molécules voisines aux coins du tétraèdre orientées de manière à avoir les atomes d'hydrogène et d'oxygène proches les uns des autres:
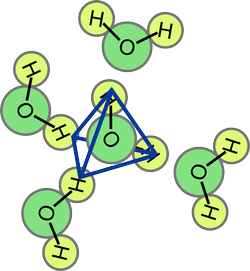
Une image grossière de l'eau liquide tenant compte des liaisons hydrogènes est donnée dans la figure ci-dessous. Des groupes de molécules s'arrangent en tétraèdres mais les différents tétraèdres ne sont pas tous orientés de la même façon. En présence de la paille chargée, les tétraèdres ont tendance à s'aligner de manière à ce que les charges $-$ des dipôles les constituant soient proches de la paille.
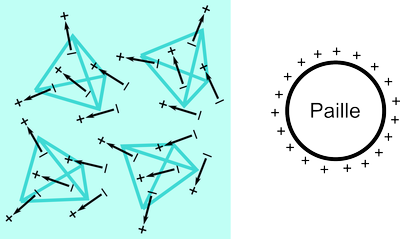
Mais comment ces structures tétraédriques augmentent-elles la force d'attraction avec la paille? Le fait d'avoir, dans un tétraèdre des dipôles dont le $+$ fait face au $-$ d'un dipôle voisin tend à déplacer le nuage électronique (négatif) des molécules vers les atomes d'hydrogène des molécules voisines (zone $+$ de leur dipôle). Cela a pour effet d'augmenter la séparation entre les charges $+$ et $-$ des dipôles, ce qui augmente également l'interaction entre les dipôles et le champ électrique extérieur créé par la paille. La force attractive est donc plus forte que si les molécules d'eau ne s'ordonnaient pas localement en tétraèdres.
