Introduction
Pourquoi l'eau de mer et des océans est-elle salée? Une réponse simple fait intervenir le cycle de l'eau sur Terre. Mais le problème est en réalité très complexe et certains phénomènes déterminant la salinité de l'eau sont encore mal compris.
L'eau de mer est plus salée que celles des fleuves en raison du cycle de l'eau
L'eau sur Terre suit le cycle suivant:
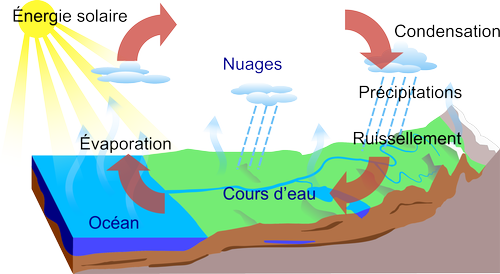
En pleuvant, de l'eau à peu près pure ruisselle sur la Terre, forme des lacs, des nappes phréatiques et s'écoule dans des fleuves. Dans tous ces cas, l'eau est en contact direct avec de la terre ou des roches et des minéraux provenant du sol se dissolvent dans l'eau sous la forme d'ions. L'eau des fleuves n'est donc pas totalement pure. Elle est déjà un peu salée, mais avec une concentration en ions très faible. L'eau des fleuves se déverse ensuite avec les ions dissouts dans une mer ou un océan. Les océans constituent la majeure partie de la surface de la Terre. Grâce à la chaleur procurée par le soleil, l'eau s'évapore à la surface des océans. Or, les ions ne s'évaporent pas. Ils sont donc contraints de rester dans les océans.
Les océans existent depuis très longtemps. Selon la théorie la plus communément admise, ils ont commencé à se former il y a environ 4 milliards d'années lorsque la température de l'atmosphère est devenue suffisamment basse pour que la vapeur d'eau qu'elle contenait puisse se condenser en eau liquide. En plusieurs milliards d'années, l'eau a eu le temps d'effectuer de nombreux cycles sur Terre et des ions provenant initialement du sol se sont accumulés dans les océans: la salinité a augmenté. Les océans et les mers sont donc plus salés que les fleuves.
Pourquoi l'eau de mer n'est-elle donc pas saturée en sel?
Si du sel s'accumule dans l'eau de mer, sa concentration augmente. Mais jusqu'à quand? Deux scénarios simples sont possibles:
-
Scénario 1: La concentration en sel atteint la valeur maximale possible dans l'eau (saturation). Si cette concentration est atteinte, l'évaporation de l'eau va provoquer la précipitation de sel (phénomène inverse de la dissolution), et des cristaux de sels vont se former er tomber au fond des océans par sédimentation. C'est en raison du même phénomène de saturation qu'il n'est pas possible de dissoudre une quantité infinie de sel de table dans un verre d'eau, même en mélangeant beaucoup.
-
Scénario 2: La concentration en sel n'a pas encore atteint la saturation et augmente donc toujours aujourd'hui (mais très lentement, car les océans sont très grands par rapport au débit des fleuves).
Lequel de ces deux scénarios est correct? En ouvrant un livre de chimie, on trouve qu'on peut avoir au maximum 360 grammes de chlorure de sodium (sel de table) dissouts dans 1 litre de solution, soit une concentration de saturation de 360 g/L en sel. Or, l'eau de mer a une salinité de 35 g/L seulement (en incluant tous les ions, mais ce sont principalement des ions chlorure et sodium). On n'a donc pas encore atteint la saturation. Par déduction, la concentration doit donc augmenter avec le temps selon le scénario 2. Pourtant, on sait que la composition de l'eau de mer est constante depuis environ un milliard d'années.
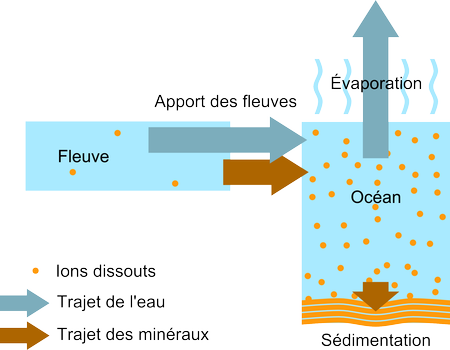
Aucune des deux théories ci-dessus ne peut expliquer que la concentration en sel des océans est constante à une valeur en dessous de la concentration de saturation. Il se passe donc autre chose dans les océans. Comme l'eau s'évapore toujours aujourd'hui des océans et que les fleuves les alimentent toujours en eau avec des ions, le seul moyen de ne pas voir augmenter la concentration est d'avoir une précipitation et sédimentation des minéraux pour avoir un océan à l'équilibre. Et il faut trouver un mécanisme qui explique pourquoi les ions se re-solidifient en dessous de leur concentration de saturation.
Les océans, avec tout ce qu'ils contiennent, sont en fait un système très complexe. En particulier, des organismes vivants interagissent avec leur environnement. Chaque mollusque absorbe des ions calcium pour construire sa coquille, qui va ensuite sédimenter à la mort de l'animal. Les diatomées (micro-algues unicellulaires) font de même avec les ions silice de l'eau. De nombreux organismes affectent ainsi la composition en ions des océans en favorisant la sédimentation et, depuis un milliard d'années, un équilibre a été atteint entre les ions fournis par les fleuves qui augmentent la concentration en minéraux des océans et la sédimentation par la voie de la vie marine qui consomme ces minéraux et les dépose au fond des océans.
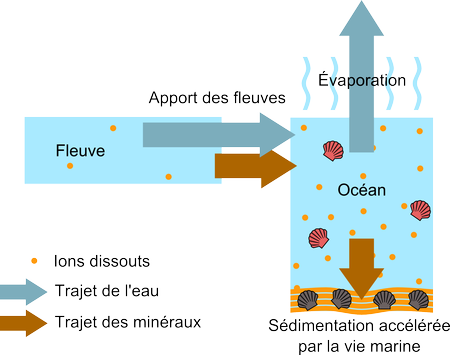
Un indice en faveur de ce mécanisme de sédimentation par voie marine se cache derrière les données détaillées de concentration en chaque type d'ion des fleuves et des océans. Les ions des fleuves sont principalement des ions bicarbonate, calcium et silice. Dans l'eau de mer, leurs concentrations deviennent négligeables et ce sont les ions chlorure et sodium qui dominent. Un tel changement de proportions n'est possible que si les différents types d'ions sédimentent différemment, ce qui est vraisemblable dans un scénario ou les animaux marins consomment des ions surtout pour fabriquer des coquilles (qui nécessitent les ions calcium, silice et bicarbonate).
Conclusion
La composition des océans est en équilibre depuis très longtemps. Des ions sont constamment apportés par les fleuves et consommés par les organismes marins. Des mécanismes biologiques favorisent la sédimentation des minéraux et les océans ne sont donc pas saturés en ions.
La biologie des organismes n'est cependant pas entièrement comprise. En particulier, aucun mécanisme biologique de consommation des ions sodium n'est connu. La vie marine n'explique donc peut-être pas entièrement la composition des océans.
Références
En anglais:
-
Why is the Ocean Salty?, Herbert Swenson, US Geological Survey Publication
-
The Origin of the Ocean - The Water Planet (présentation PowerPoint)
