Ce qu'il te faut
- Casserole
- Sel
- Plaque de cuisson
- Balance (précision de 1 g au moins)
- Un grand récipient (1 L au moins)
- Grande cuillère
- Thermomètre (gamme de 0 à 120°C et précision de 1°C au moins)
- Chronomètre
- Papier, crayon
- Facultatif : Ordinateur pour tracer des graphes
Introduction
Quand on dit que l'eau bout à 100°C, ce n'est en fait vrai que pour de l'eau pure et à pression atmosphérique. Dans ce cas, une caractéristique intéressante, à chauffage constant, de l'évolution de la température en fonction du temps montre que la température se stabilise à 100°C pendant que l'eau continue à bouillir. Pour de l'eau qui n'est pas pure, comme de l'eau salée, la température d'ébullition est différente, et la vaporisation de l'eau conduit à des courbes de température plus complexes. Cette page décrit une expérience pour mesurer ces courbes et explique les différentes variations observées.
 |
Danger de brulures. Utilise des éléments de protection adaptés (gants, etc.). |
| Réalise cette expérience en présence d'un adulte. |

Expérience
A propos du matériel
Plaque de cuisson
Dans l'expérience, il va falloir chauffer idéalement à puissance constante. Les plaques à gaz fonctionneront très bien car elles contrôlent le flux de gaz et donc d'énergie apportée. La plupart des plaques à induction fonctionneront aussi si elles n'ont pas de sonde de température intégrée. Les plaques électriques risquent de poser problème car elles utilisent généralement un thermostat mécanique, qui allume ou éteint la plaque selon qu'elle soit trop froide ou chaude. Ces plaques contrôlent donc en théorie la température, ce qui n'est pas bon pour cette expérience (et en pratique, le contrôle est en plus mauvais, notamment car la température du thermostat n'est souvent pas celle de la casserole). Dans le cas des plaques à induction avec contrôle de température et des plaques électriques, l'expérience devrait quand-même marcher en les réglant sur position maximale, c'est-à-dire avec une température de consigne très supérieure à la température d'ébullition de l'eau, de manière à ce que la plaque chauffe sans temps d'arrêt, car elle n'atteindra jamais la température de consigne. Pour les plaques au gaz, il est recommandé d'utiliser un feu moyen.
Thermomètre
Il faut bien prendre un thermomètre qui va résister aux températures élevées (au moins 120°C, pour être sûr). Surtout pas de thermomètre à alcool qui exploserait vers 78°C. Les thermomètres électroniques avec une sonde séparée sont pratiques car on peut placer l'afficheur du thermomètre loin de la casserole, ce qui facilite la lecture de la température sans toucher la sonde.
J'ai moi-même utilisé un thermomètre qui enregistre automatiquement la température à intervalles réguliers, ce qui est plus pratique que d'avoir à noter la température toutes les 30 s. Celui-ci était une Raspberry Pi avec un montage similaire à celui-ci.
Ébullition d'eau du robinet
Pour cette expérience, l'eau du robinet est une bonne approximation de l'eau pure. Mesure 500 g d'eau et place-la dans la casserole. Immerge le thermomètre. Fais en sorte qu'il ne bouge pas trop dans la casserole au cours de l'expérience. Dans le cas d'une sonde reliée à un fil, tu peux scotcher le fil le long du manche de la casserole. La casserole ne doit pas être couverte.

Prépare le chronomètre et de quoi noter la température (papier/crayon ou directement sur un ordinateur). Allume la plaque au maximum ou le gaz à feu moyen et démarre le chronomètre en même temps. Note ensuite toutes les 30 s le temps, la température, et si des changements visibles se produisent dans la casserole (apparition de bulles, grosse ébullition, etc.).
Après quelques minutes, la température devrait se stabiliser vers 100°C. Mais l'expérience n'est pas terminée! Lors de l'ébullition, l'eau se vaporise et le volume de liquide diminue dans la casserole. Continue de mesurer la température et arrête les mesures quand elle se remet à varier brutalement. Ces variations finales de température, mesurées au niveau de la sonde, se produisent quand le niveau de liquide est tellement bas que la sonde n'est plus suffisamment immergée et que la température mesurée n'est alors plus celle de l'eau liquide. Ceci peut prendre plusieurs dizaines de minutes. Arrête alors la plaque de cuisson.
Trace sur un graphique la température en fonction du temps, comme ci-dessous:
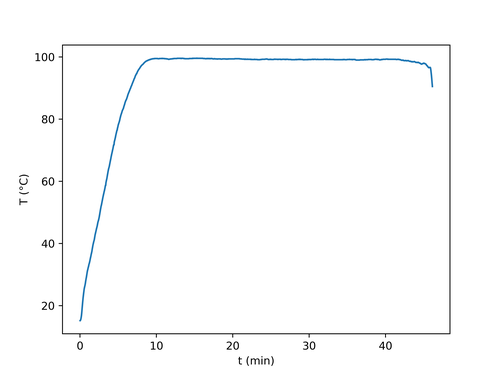
Si tu obtiens une courbe semblable à celle-ci (en particulier avec une forte montée au début, puis un plateau), c'est que l'expérience a bien marché. Dans ce cas, tu peux continuer avec les expériences suivantes.
Ébullition d'eau salée
Concentration de 15 % (150 grammes de sel par kilogramme de solution)
Pour la deuxième expérience, il faut fabriquer une solution d'eau salée:
-
Mesure 75 g de sel dans un grand récipient.
-
Complète avec de l'eau jusqu'à une masse totale de 500 g.
-
Mélange vigoureusement jusqu'à dissolution totale du sel.
-
Verse ce mélange dans la casserole.
-
Chauffe tout en mesurant la température comme dans l'expérience précédente.
Enfin, trace la courbe de température sur le même graphe que précédemment.
Concentration de 10 % (100 g/kg)
Pour bien comprendre l'effet du sel, fais une dernière expérience d'ébullition d'eau salée, mais avec une concentration en sel de 100 g/kg. Pour cela, reproduis la deuxième expérience, mais en utilisant une masse de sel de 50 g au lieu de 75 g.
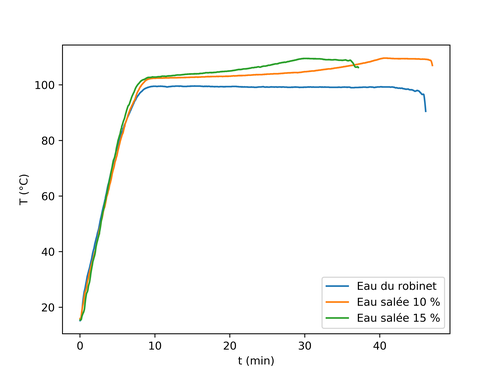
Après avoir tracé les trois courbes, le graphique devrait ressembler à ceci:
Interprétation des courbes de température
Courbe de l'eau du robinet
Montée en température
Dans le cas de l'eau du robinet, la courbe est assez simple: Après une forte montée de la température, celle-ci se stabilise à une valeur constante, proche de 100°C. Chauffer une substance conduit généralement à une élévation de sa température et c'est ce qui se passe lors de la montée initiale. En fournissant une puissance constante de chaleur à l'eau, elle chauffe, c'est-à-dire qu'elle emmagasine la chaleur qu'on lui apporte sous la forme d'agitation thermique: les molécules qui constituent l'eau bougent plus les unes par rapport aux autres. Or les thermomètres mesurent cette agitation thermique, et la température augmente donc.
Palier de température
La partie plus étrange de la courbe correspond à ce qui se passe au delà de 9 minutes. A ce temps là, la température se stabilise brusquement puis reste constante pendant plusieurs dizaines de minutes. C'est aussi vers ce temps que l'eau s'est mise à bouillir à gros bouillons (avant cela, il y a des frémissements). Alors qu'on continue à apporter un flux de chaleur constant à l'eau, sa température ne grimpe plus! Cela signifie que la nouvelle énergie apportée ne contribue plus à augmenter l'agitation thermique dans l'eau liquide. A la place, l'énergie doit être utilisée par l'eau pour faire autre chose: en bouillant, l'eau liquide se transforme en eau vapeur (d'où la présence de grosses bulles). On a donc lors du palier un changement d'état. Or, faire changer d'état de l'eau liquide en gaz demande beaucoup d'énergie et toute l'énergie qu'on apporte avec la plaque est utilisée pour transformer l'eau. Au fur et à mesure que l'eau se transforme, le volume d'eau liquide dans la casserole diminue. Il arrive alors un moment où le thermomètre ne trempe plus complètement dans le liquide et la température se remet à changer rapidement.
Température de changement d'état
Lors du palier de température, un changement d'état a lieu. Pour un composé pur, un changement d'état (liquide/solide, liquide/gaz...) est un phénomène qui est caractérisé par des conditions thermodynamiques très précises: les changements d'états ne se produisent que pour des températures et pressions données. Pour l'eau pure, la température de changement d'état liquide/gaz est de 100°C lorsque la pression est de 1013,25 hPa (hectopascals), ce qui est la pression atmosphérique moyenne à une altitude au niveau de la mer. A des altitudes plus élevées, l'eau bout à une température plus faible. Ainsi, le plateau de température n'est pas forcément à exactement 100°C en fonction de l'endroit où l'expérience est faite. Des imprécisions du thermomètre peuvent aussi conduire à des écarts de température. La valeur de la température au palier peut donc varier de quelques degrés selon les conditions de l'expérience. Dans le cas du graphique ci-dessus, le palier se situe à 99°C.
Courbes de l'eau salée
Dans le cas de l'eau salée, les courbes sont différentes et dépendent de la concentration en sel (courbes orange et verte).
Montée initiale de la température
La montée initiale en température (jusqu'à environ 9 minutes) est très semblable pour les cas avec et sans sel. La différence principale est que la montée s'arrête à une température un peu plus élevée avec l'eau salée. Comme la fin de cette montée indique le début de l'ébullition, cela signifie que l'eau salée bout à une température plus élevée que l'eau du robinet.
Un plateau remplacé par des variations plus complexes pour l'eau salée
La toute fin des courbes orange et verte est similaire à la fin de la courbe bleue pour l'eau du robinet. Les chutes finales de température correspondent toujours à un défaut dans la mesure de la température quand il n'y a plus assez d'eau dans la casserole. La partie des courbes qui reste à comprendre est entre la montée initiale et cette chute finale.
Si on considère par exemple la courbe verte, la partie entre 9 et 37 min environ devrait correspondre à la partie où on avait un plateau pour l'eau du robinet. Mais pour l'eau salée, à la place d'un plateau, cette fenêtre de temps contient deux phases:
-
Une phase de 9 à 30 min où la température monte, mais beaucoup plus lentement que lors de la montée initiale de 0 à 9 min. Lors de la montée faible, tu as du voir que l'eau salée bouillait.
-
Une phase de 30 à 37 min où la température est à peu près constante. Dans cette phase, l'eau bout aussi. Mais, dans ce cas, tu as du voir des solides blancs apparaitre dans l'eau: ce sont des cristaux de sel.
Lors de la première de ces deux phases, l'eau bout, et on est donc à la température d'ébullition du mélange. Or, de la même manière que la température d'ébullition de l'eau pure prend une valeur bien précise qui dépend de la pression, pour l'eau salée, cette valeur dépend à la fois de la pression et de la concentration en sel. Plus précisément, elle augmente avec la concentration. (On le voit d'ailleurs dès le début de cette phase où la température est déjà plus haute que le plateau de l'eau pure en raison du sel.) Mais au fur et à mesure que l'eau s'évapore, la concentration en sel dans la casserole augmente, car le sel, lui ne s'évapore pas et doit donc rester dans la phase liquide. Comme la concentration augmente, la température d'ébullition du mélange augmente au lieu de rester constante. Et vu que l'évaporation prend du temps car nécessitant beaucoup d'énergie, la concentration en sel augmente très lentement (par rapport à la montée initiale), et donc la température aussi.
Lors du début de la phase qui suit (de 30 à 37 min pour la courbe verte), des cristaux de sel apparaissent dans la casserole. En augmentant petit à petit la concentration en sel, le liquide a atteint la concentration de saturation, c'est-à-dire la concentration maximale de sel qu'il peut maintenir dissout. La concentration de saturation est une constante qui existe pour de nombreux cristaux solubles dans l'eau, et tu peux facilement tester qu'en ajoutant du sel dans un verre d'eau, il est possible pour de faibles quantités de le dissoudre entièrement en mélangeant bien, mais qu'à partir d'une certaine quantité de sel ajouté, il n'est plus possible de le dissoudre. Dans la phase de 30 à 37 minutes, le mélange continue à bouillir et donc à vaporiser de l'eau. Mais comme il n'est plus possible d'augmenter la concentration en sel dans le liquide, le système la garde constante (à la valeur de saturation), et doit donc pour cela obligatoirement transformer une partie du sel dissout en sel solide. La concentration étant constante, la température d'ébullition qui dépend de la concentration reste aussi constante. Si on va jusqu'à la fin de l'ébullition, on obtiendrait dans la casserole uniquement du sel solide.
Comparaison des courbes pour différentes concentrations en sel
Regardons maintenant à la fois les courbes orange et verte qui correspondent à des concentrations initiales en sel de 10 et 15 %. On observe principalement deux différences:
-
Le début de la montée douce commence à une température légèrement plus élevée pour l'expérience à concentration initiale élevée. C'est tout à fait logique car on a vu que la température d'ébullition augmente avec la concentration et, à ce point là, la concentration en sel est plus élevée lors de l'expérience de la courbe verte que celle de la courbe orange.
-
Le début du plateau constant se produit à 30 min pour la solution la plus concentrée initialement, et 41 min pour l'autre. Ce plateau se produit cependant à la même température. Ceci est normal car la concentration de saturation en sel est la même dans les deux cas, ce qui donne la même température d'ébullition au plateau. Mais comme la solution la plus concentrée en sel a besoin de vaporiser moins d'eau pour atteindre la concentration de saturation, celle-ci est atteinte plus tôt.
Conclusion
Alors que la courbe de température de l'eau pure chauffée est relativement simple, avec un plateau dès que la température d'ébullition est atteinte, les courbes pour l'eau salée sont plus compliquées! Elles ont permis de comprendre plusieurs phénomènes liées aux transitions de phase:
-
La température d'ébullition d'un mélange (comme de l'eau avec du sel dissout), dépend de la concentration.
-
En faisant bouillir un mélange, en plus de vaporiser du liquide, on peut aussi créer une nouvelle phase (du sel solide dans notre cas). Lorsque que cela se produit, on est à la concentration de saturation.
