Ce qu'il te faut
- Des billes de gel superabsorbant (voir plus bas où en trouver)
- 10 L d'eau déminéralisée
- Du sel de cuisine
- 7 grands verres
- Une balance (précision de 1 g au moins)
- Un verre gradué
- Une bouteille de 2 L avec bouchon
Introduction
Les billes de gel sont faites en polymère superabsorbant. D'abord sèches et de quelques millimètres de diamètre, elles grossissent lorsqu'elles sont trempées dans l'eau. Cependant, leur taille finale est très dépendante de la quantité d'ions (sel par exemple) dans l'eau. Observe ce phénomène avec cette expérience, et estime en bonus la quantité d'ions dans de l'eau du robinet ou de l'eau minérale.
Pour plus de détails sur les polymères superabsorbants, et savoir comment ça marche, vois cette page.

Où trouver des billes de gel ?
Ces billes sont vendues en petits sachets de quelques grammes en temps qu'objets décoratifs (à mettre dans un vase transparent), ou comme rétenteur d'eau en jardinage ou pour des plantes d'intérieur. Il y a tout un tas de sites web qui en vendent; voici juste quelques exemples : Art Floral, Cubicolor et Florimat.
Expérience d'absorption d'eau
Pour commencer à se familiariser avec ces billes, prends en quelques-unes. Quand elles sont sèches, elles sont solides et font environ 3 mm de diamètre (la taille des tiennes peut différer sensiblement). Place-les dans un verre d'eau déminéralisée (l'effet est plus spectaculaire qu'avec de l'eau du robinet). Les billes grossissent très lentement : au bout d'une demi-heure ou une heure tu devrais obtenir une grosse bille non sphérique en forme de cervelle :

Les billes en forme de cervelle n'ont en fait pas encore fini de grandir et voilà ce que tu obtiens après plusieurs heures (au moins 8 heures) :


Joue un peu avec les grosses billes obtenues : elles sont élastiques comme des balles rebondissantes, mais un peu fragiles. Si tu les lances un peu trop fort ou si tu les presse entre tes doigts, elle éclatent en petits morceaux.
La conclusion de cette expérience est que les billes de gel peuvent absorber une grande quantité d'eau mais que ça prend plusieurs heures.
Expérience d'absorption d'eau en fonction de la salinité de l'eau
L'idée de cette expérience est de mesurer des quantités de liquide absorbé par des billes de gel pour différentes solutions d'eau salée (différentes concentrations en sel).
Préparation des solutions
Prépare un par un des verres de différentes solutions d'eau avec des concentrations de 0; 0,5; 1; 2; 5 et 15 g/L de sel de cette manière :
-
Avec le verre gradué, remplis la bouteille avec un volume $V = 2\,\text{L}$ d'eau déminéralisée (cas des solutions à 0.5 et 1 g/L) ou $V = 1\,\text{L}$ (pour toutes les autres solutions).
-
Rajoute une masse $m_{\text{s}}$ de sel (sauf pour la solution à 0 g/L...) pour obtenir la concentration voulue en utilisant la formule suivante
$$m_{\text s} = c V$$
$c$ est la concentration en g/L. Ainsi pour les solutions à 0,5 et 1 g/L, il faut rajouter respectivement 1 g et 2 g de sel (dans les 2 L d'eau). Et pour les solutions à 2; 5 et 15 g/L, il suffit de rajouter respectivement 2; 5 et 15 g de sel.
La raison pour laquelle les solutions à basse concentration sont faites avec 2 L de liquide est qu'une balance de cuisine a généralement une précision de 1 g au mieux, et il est serait difficile de mesurer des petites masses telles que 0,5 g de sel.
-
Ferme la bouteille et secoue-la jusqu'à ce que tout le sel soit dissout : l'eau doit être bien transparente et tous les cristaux de sel doivent disparaitre.
-
Remplis un verre avec cette solution.
Tu dois alors avoir 6 verres de solutions à différentes concentrations de sel. Aligne-les dans l'ordre croissant des concentrations. Remplis enfin un septième verre d'eau du robinet et mets-le de côté.
Préparation des billes
Maintenant, il va falloir mettre des billes dans les verres. Pour mesurer des quantités d'eau absorbées, il "suffit" de mesurer la masse d'une bille sèche, de la tremper dans la solution voulue, et de mesurer sa masse finale après plusieurs heures. Le problème est que la masse d'une bille est trop petit pour pouvoir être mesuré avec une balance (sauf si c'est une balance de précision de laboratoire). Pour résoudre ce problème, on peut faire l'expérience avec plus d'une bille par verre.
Détermination de la masse moyenne d'une bille
Pour mesurer la masse moyenne d'une bille sèche, prépare un tas d'au moins 400 billes en les comptant (ça prend un peu de temps...). Mesure la masse $M$ du tas. La masse moyenne $m$ d'une bille est donnée par la formule suivante :
$$m = \frac{M}{N_0}$$avec $N_0$ le nombre de billes du tas. Dans mon expérience, j'ai trouvé une masse moyenne de 0.0225 g. Il se peut que tu aies une valeur différente.
Préparation des verres de billes
Maintenant, prépare 7 tas de $N = 50$ billes chacun et verse-les dans les verres. Attends alors au moins 24 heures pour être sûr que les billes absorbent le maximum d'eau possible.
Observations
Après 24 heures, vide les verres de leur solution en gardant les billes à l'intérieur. Assure-toi que les billes sont bien égouttées. Tu devrais voir que plus plus la concentration en sel est élevée, plus les billes sont petites (voir l'image en haut de cette page).
Mesure des masses des billes de gel
Pour chaque verre, mesure avec la balance la masse des 50 billes de gel obtenues et note le résultat en grammes dans un tableau. Calcule aussi dans chaque cas la masse moyenne d'une bille de gel (avec son eau) en divisant par 50 comme ci-dessous :
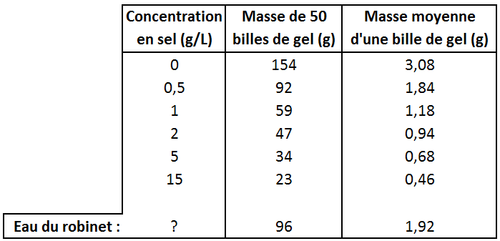
Arrête-toi quelques instants sur le cas des billes dans l'eau déminéralisée, qui sont celles qui ont absorbé le plus d'eau. Tu peux estimer une quantité cool qui est combien de fois elles ont absorbé leur masse initiale en eau. Il suffit de diviser leur masse moyenne finale (à peu près égale à la masse d'eau absorbée) par la masse moyenne d'une bille avant absorption d'eau. Dans mon cas, j'ai trouvé qu'une bille de gel pouvait absorber jusqu'à 137 sa masse en eau ! Autrement dit, une bille de gel contient plus de 99 % de liquide piégé quand elle a été trempée dans de l'eau déminéralisée !
Représentation des résultats sur un graphe
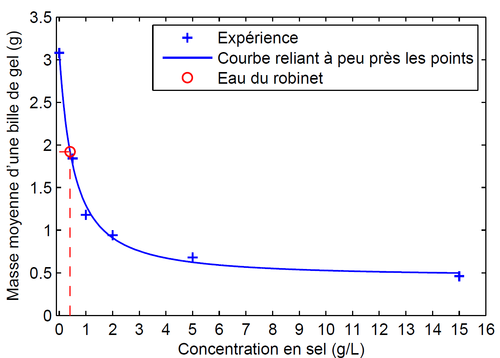
Représente la masse moyenne d'eau absorbée en fonction de la concentration en sel, comme ci-dessous.
En utilisant ce graphe, tu peux déterminer la concentration en sels dans l'eau. Relie à peu près les points (croix sur le graphe ci-dessous) par une courbe lissée. Il suffit alors de regarder sur cette courbe lissée à quelle concentration correspond la masse moyenne d'une bille trempée dans l'eau du robinet (que tu viens de mesurer). Sur mes données, la masse était de 1,92 g, donc j'ai placé sur le graphe le point d'ordonnée 1,92 et qui passe par la courbe lisse (point rouge). En regardant l'abscisse de ce point, on obtient une concentration de 0,4 g/L. C'est la concentration en sels de l'eau du robinet.
Commentaire sur la concentration en sels de l'eau du robinet
En réalité, l'eau du robinet ne contient pas seulement du sel comme le sel de cuisine (NaCl, chlorure de sodium). C'est en fait un mélange d'ions dissous dans l'eau. L'expérience ici mesure en fait la concentration totale de charges électriques dans l'eau, c'est-à-dire en gros la somme des concentrations d'ions que l'on y trouve : $\text{Na}^+$, $\text{Cl}^-$, $\text{Mg}^{2+}$, etc. De plus, c'est la quantité de charges qui compte (pas le nombre d'ions), c'est-à-dire qu'un ion $\text{Mg}^{2+}$ est compté comme deux ions $\text{Na}^+$.
Pour avoir une idée de pourquoi c'est la concentration de charges qui compte, vois la page d'explication sur les polymères superabsorbants.
Pour aller plus loin
La courbe de calibration que tu as tracée peut te servir à déterminer les concentrations de différentes solutions aqueuses. Tu peux par exemple essayer de l'eau minérale, de l'eau de pluie, d'un fleuve, d'un torrent de montagne, de mer, d'un lac... et comparer les différentes concentrations.
